产(chǎn)品信息
1.人用(yòng)狂犬病疫苗(地鼠肾细胞)产(chǎn)品信息
-
- 1.产(chǎn)品名(míng)称及产(chǎn)品代码:
通用(yòng)名(míng)称:人用(yòng)狂犬病疫苗(地鼠肾细胞)
英文(wén)名(míng)称: Rabies Vaccine(Hamster Kidney Cell)for Human Use
汉语拼音: Renyong Kuangquanbing Yimiao(Dishushen Xibao)
产(chǎn)品代码:7011
批准文(wén)号:國(guó)药准字S20000044
执行标准:WS4-(ZB-003)-2011
产(chǎn)品剂型:小(xiǎo)容量注射剂。
-
- 2.产(chǎn)品简述:
本品系用(yòng)狂犬病病毒固定毒接种原代地鼠肾细胞,经培养、收获病毒液、灭活病毒、浓缩、纯化后,加入人血白蛋白作(zuò)為(wèi)稳定剂,以PBS稀释制成,為(wèi)无色澄明液體(tǐ)。
最小(xiǎo)包装(zhuāng)规格:单瓶包装(zhuāng);单瓶包装(zhuāng)(附玻璃注射器);五瓶包装(zhuāng)
-
- 3.产(chǎn)品特点
●安(ān)全性高:
河南遠(yuǎn)大生物(wù)制药有(yǒu)限公(gōng)司于2000年在全國(guó)首家率先推出了“无佐剂” 人用(yòng)精(jīng)制狂犬病疫苗(地鼠肾细胞),并获得了國(guó)家药监局签发的新(xīn)药证书及生产(chǎn)批件。
生产(chǎn)用(yòng)细胞基质(zhì)為(wèi)原代地鼠肾细胞。原代细胞培养,离體(tǐ)时间短,其生物(wù)學(xué)性状与母體(tǐ)一致,染色體(tǐ)核型与基因核型未发生改变;细胞安(ān)全性高,不存在致肿瘤风险。
●产(chǎn)品质(zhì)量可(kě)靠,保护效果好:
产(chǎn)品批签发及抽样合格率始终為(wèi)100%。曾经作(zuò)為(wèi)國(guó)家“十五”攻关项目的研究用(yòng)疫苗参与狂犬病疫苗临床免疫效果的观测研究,结果表明河南遠(yuǎn)大生物(wù)生产(chǎn)的人用(yòng)狂犬病疫苗(地鼠肾细胞)具(jù)有(yǒu)良好的安(ān)全性和保护效果。
●疑似预防接种异常反应低:
人用(yòng)狂犬病疫苗(地鼠肾细胞)上市销售十余年来,没有(yǒu)出现严重和新(xīn)的疑似预防接种异常反应,2023年疑似预防接种异常反应发生率為(wèi)0.51‰。
2.说明书和标签
人用(yòng)狂犬病疫苗(地鼠肾细胞)瓶签:适用(yòng)五瓶包装(zhuāng)、单瓶包装(zhuāng)

人用(yòng)狂犬病疫苗(地鼠肾细胞)说明书:适用(yòng)五瓶包装(zhuāng)、单瓶包装(zhuāng)

3.药品相关质(zhì)量管理(lǐ)规范执行情况
3.1.疫苗上市许可(kě)持有(yǒu)人职责
河南遠(yuǎn)大生物(wù)制药有(yǒu)限公(gōng)司在日常生产(chǎn)质(zhì)量活动中(zhōng)严格执行《药品管理(lǐ)法》、《疫苗管理(lǐ)法》和《药品生产(chǎn)质(zhì)量管理(lǐ)规范》,在研制、生产(chǎn)、经营、储存、运输过程中(zhōng)履行疫苗上市许可(kě)持有(yǒu)人的职责,确保公(gōng)众用(yòng)药安(ān)全。
3.2.质(zhì)量管理(lǐ)體(tǐ)系
公(gōng)司建立了健全的质(zhì)量管理(lǐ)體(tǐ)系,在公(gōng)司总经理(lǐ)直接领导下,由质(zhì)量受权人管理(lǐ)全公(gōng)司质(zhì)量工(gōng)作(zuò),各岗位人员的职责明确;质(zhì)量管理(lǐ)工(gōng)作(zuò)由质(zhì)量保证(QA)、质(zhì)量控制(QC)两个部门共同承担,配备學(xué)历和经验符合要求的人员并履行相关质(zhì)量职能(néng)。
质(zhì)量保证部建立了验证与确认、变更控制、偏差处理(lǐ)、质(zhì)量风险管理(lǐ)、CAPA 管理(lǐ)、自检、投诉与召回等管理(lǐ)规程;开展确认和验证、产(chǎn)品质(zhì)量回顾、自检和外部质(zhì)量审计等工(gōng)作(zuò)。定期开展洁净區(qū)环境监测等工(gōng)作(zuò);建立药品召回系统,确保能(néng)够召回任何一批已发运销售的产(chǎn)品。
质(zhì)量控制实验室按照文(wén)件要求开展原辅料、包装(zhuāng)材料、中(zhōng)间體(tǐ)、成品等检测工(gōng)作(zuò),定期开展洁净區(qū)微生物(wù)数、工(gōng)艺用(yòng)水等的检测。设有(yǒu)独立的微生物(wù)限度检查室、阳性对照室,理(lǐ)化实验室设有(yǒu)天平室、标化室、化學(xué)分(fēn)析室、仪器室、精(jīng)密仪器室、留样等。配备了检验所需的检验仪器。制定了留样、稳定性考察和产(chǎn)品放行等相关的质(zhì)量控制文(wén)件,并按照文(wén)件要求开展质(zhì)量控制活动。对检验方法进行了验证或确认。制定原辅料、中(zhōng)间产(chǎn)品、成品、工(gōng)艺用(yòng)水、包材等检验操作(zuò)规程并按照规程对每批原辅料、中(zhōng)间产(chǎn)品、成品、工(gōng)艺用(yòng)水、包材等进行检验。每批产(chǎn)品经质(zhì)量受权人批准后方可(kě)放行。
公(gōng)司设立药物(wù)警戒部履行药品上市后风险管理(lǐ)和上市后再评价职责,有(yǒu)效控制疫苗上市后风险。
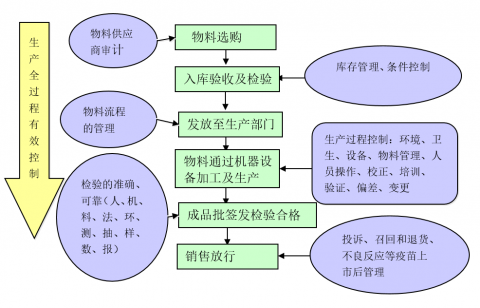
3.3.疫苗生产(chǎn)全过程管理(lǐ)
4.批签发情况
2023年,共获得批签发合格证明27批,批签发合格率100%。
5.召回情况
未发生产(chǎn)品召回情况。
6.接受检查和处罚情况
2023年共接受省级、第一监管分(fēn)局检查6次,未受到药监部门任何处罚。
7.疫苗责任强制保险
已与中(zhōng)华联合财产(chǎn)保险股份有(yǒu)限公(gōng)司郑州中(zhōng)心支公(gōng)司签订疫苗产(chǎn)品责任险。